研究内容
哺乳類概日リズムの分子時計のモニター実験系の確立
Per1:lucの組み換え動物のSCNの発光リズム
地球上の生物の行動や代謝などには約一日を周期とする体内時計が制御する概日リズムが存在し、その位相は外界の光環境などにより変化する。哺乳類の概日リズムの中枢は視交叉上核(SCN)に存在することが明らかになっているが、リズムのオシレーター機能においてPeriod1(Per1)遺伝子のSCNにおける発現振動が重要であること、また、リズムの光環境への同調はPer1の転写の光誘導に由来することをこれまでに示した。このPer1の発現を指標にして、中枢SCN及び末梢組織の時計機能を同時に測定するため、Per1プロモーター発現制御領域で蛍の発光ルシフェラーゼ(luc)遺伝子を発現するPer1::luc トランスジェニック動物を作った。その各組織を培養すると、SCNスライス培養では、約1日周期の化学発光振動が1ヶ月以上観察され、一方、肝臓など末梢組織でも遅れた振動位相ではあるが発光振動が観察でき、2日から6日で減衰する。哺乳類ではSCNに自律したペースメーカーが存在し、末梢の概日リズムを組織固有の位相に維持することがわかった。現在は、Per1::lucマウスなどを用いて、SCNスライスを顕微鏡とCCDカメラを組み合わせたタイムラプス計測にて3次元の画像として観察している。また、Vapor-liquid-solid(VLS)法で作成された微小刺入型マルチ電極プローブをアレイ状に並べたセンサーチップ(豊橋プローブ)を用いて、SCN脳スライスを培養しながら、できるだけ1神経細胞に近い単位で刺激をしながら、1細胞の神経活動スパイクの発火頻度を測定する。さらに、こうした、外部からの刺激により、SCN脳スライス内で24時間リズミックに観察される遺伝子発現の変化にどのような影響をきたすか観察する。また、この豊橋プローブは、その細さから実験動物に対して超低侵襲であるため、長期にわたり脳計測などが可能であるため、組み換えマウスや概日リズムなどの長期計測に最適である。
主な業績
- Resetting central and peripheral circadian oscillators in transgenic rats.
*Yamazaki S, * Numano R, *Abe M, Hida A, Takahashi R, Ueda M, Block GD, Sakaki Y, Menaker M, Tei H.Science, 288, 2000, p682-685 *equally contributed - Constitutive expression of the Period1 gene impairs behavioral and molecular circadian rhythms.
Numano R, Yamazaki S, Umeda N, Samura T, Sujino M, Takahashi R, Ueda M, Mori A, Yamada K, Sakaki Y, Inouye ST, Menaker M, Tei H.Proc Natl Acad Sci U S A, 103, 2006, p3716-3721 - Nanoscale tipped microwire arrays enhance electrical trap and depth injection of nanoparticles.
Goryu A, Numano R, Ikedo A,Ishida M, Kawano T.,
Nanotechnology Vol.23, 41, 2012 - In vivo bioluminescence and reflectance imaging of multiple organs in bioluminescence reporter mice by bundled-fiber-coupled microscopy
Ando Y, i Sakurai T, Koida K, Tei H, Hida A, Nakao K, Natsume M, and Numano R,
Biol.I Optics Eexp., 7(3), 963-978, 2016 - Single 5 μm diameter needle electrode block modules for unit recordings in vivo.
Sawahata H, Yamagiwa S, Moriya A, Dong T, Oi H, Ando Y, Numano R, Ishida M, Koida K, Kawano
T.Scientific Reports, 2016, 25;6:35806
キーワード
概日リズム、Period1、トランスジェニック動物、発現振動、豊橋プローブ、VLS法、 ペースメーカー神経
照射する光の波長により神経活動を外部コントロールできる実験系の確立
光照射による神経細胞の活動電位変化
神経細胞のイオンチャネルの活動を、光照射でコンホーメションを変化させる光感受性の人工化学物質を用いてコントロールする系を開発した。グルタミン受容体(iGluR6)は神経細胞のシナプス部位に強く発現し、神経発火の頻度を制御しているイオンチャネルである。UV領域の光でシス体となり、可視領域の光でトランス体となるアゾベンゼン構造を骨格にもち、システイン(Cys)に水素結合するマレーマイド(のりしろ)構造体とiGluR6受容体のアゴニストであるグルタミン酸を両方結合させた新規化学物質(MAG)を合成した。iGluR6のリガンド結合部位のまわりに化合物の接着部となるCys変異を導入した変異体と化学物質MAGの組み合わせにより、異なる波長の光照射で、細胞膜の電位・神経細胞の活動を可逆的に変化させることに成功した。具体的には、UV領域の光照射で受容体が開き、可視光で閉まるという光反応性をしめす組換LiGluR受容体や、反対にUV光で受容体が閉まり、可視光で開く反応を示すYin/Yang受容体を見出した。この実験系はゼブラフィッシュなどの生体内でも機能し、外部からの照射光により神経活動・行動を調節できることが示された。このLiGluR受容体やYin/Yang受容体をもちいて、SCNペースメーカー神経の神経活動を光照射で直接操作することで、哺乳類概日リズムをコントロールしている。
主な業績
- Allosteric control of an ionotropic glutamate receptor with an optical switch.
Volgraf M, Gorostiza P, Numano R, Kramer RH, Isacoff EY, Trauner D.
Nat Chem Biol., 2, 2006, p47-52 - Remote control of neuronal activity with a light-gated glutamate receptor.
Szobota S, Gorostiza P, Del Bene F, Wyart C, Fortin DL, Kolstad KD, Tulyathan O, Volgraf M, Numano R, Aaron HL, Scott EK, Kramer RH, Flannery J, Baier H, Trauner D, Isacoff EY.
Neuron, 54, 2007, p535-545 - Mechanisms of photoswitch conjugation and light activation of an ionotropic glutamate receptor.
Gorostiza P, Volgraf M, Numano R, Szobota S, Trauner D, Isacoff EY.
Proc Natl Acad Sci U S A, 104, 2007, p10865-10870 - Nanosculpting reversed wavelength sensitivity into a photoswitchable iGluR.
Numano R, Szobota S, Lau AY, Gorostiza P, Volgraf M, Roux B, Trauner D, Isacoff EY.
Proc Natl Acad Sci U S A, 106, 2009, p6814-6819
キーワード
LiGluR受容体、Yin/Yang受容体、アゾベンゼン構造、MAG、iGluR6、UV光で、可視光
遺伝子導入装置
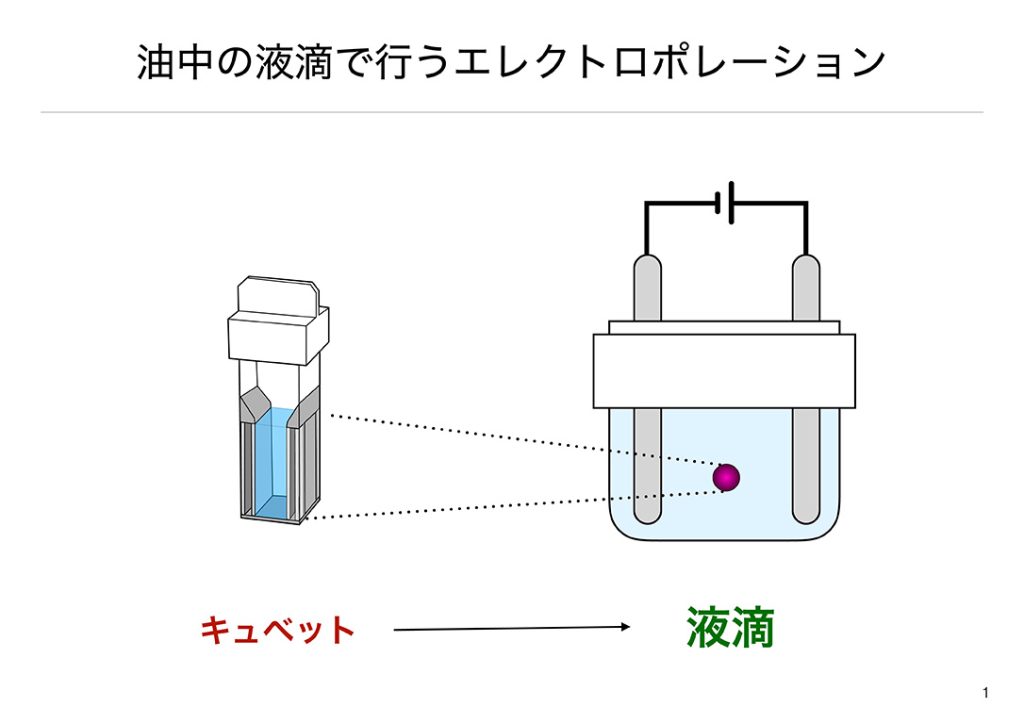
一般にエレクトロポレーション法で遺伝子導入を行う場合、キュベットと呼ばれる、二つの対になる電極を備えた容器を用います。この容器へ細胞と導入したい遺伝子が混合された液体を加え、設計された電圧を印加することにより遺伝子導入を行います。この手法では、ウイルス感染を用いないため、ほとんどの研究室で簡単に導入でき、移植に耐えうるグレードを達成できます。また、トランスフェクション試薬を用いないため、ランニングコストを低く抑えることができます。しかし、エレクトロポレーション法には細胞毒性が極めて高いと言った致命的な弱点がありました。現在、低細胞毒性を実現する物理的な遺伝子導入法の開発が急がれています。その中でも、私たちが着目したのは静電気でした。電圧や電流が高いのに電力量が低い静電気は適応細胞種の広い遺伝子導入法を確立できる可能性を持っています。ではどのように静電気を遺伝子導入時に与えるかについてみていきます。
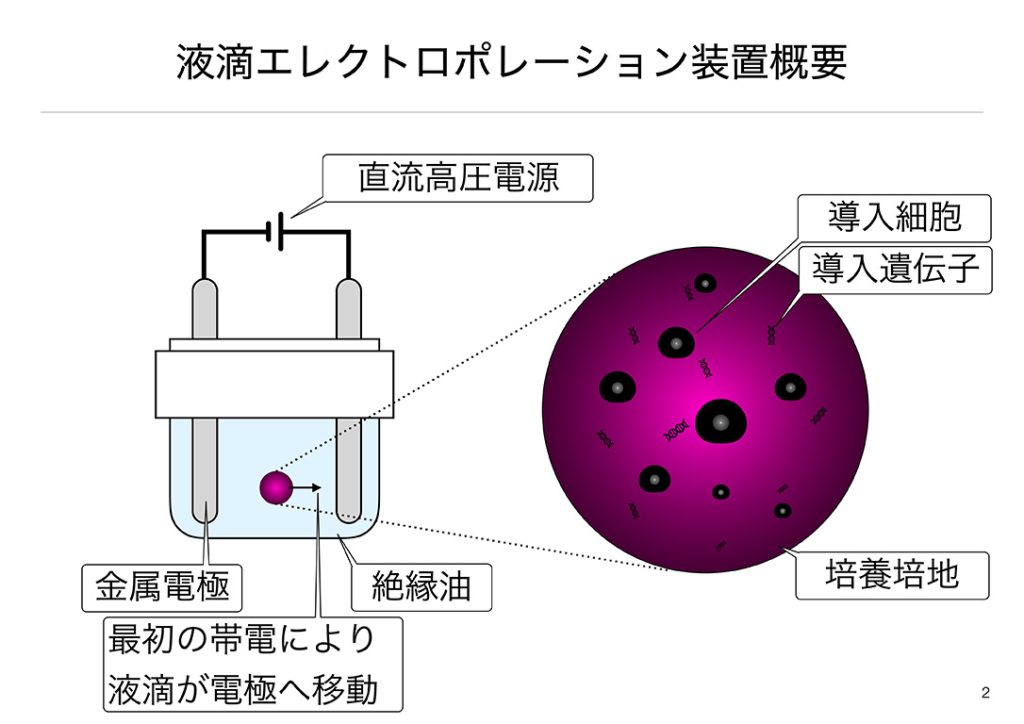
私たちが進める研究は、油と水が別れることを利用しています。まず、絶縁性の油を満たしたシャーレの中に細胞と核酸を混ぜた溶液を落とします。油の中で落とした液体が球状になり液滴が形成されます。次に、液滴のできた絶縁油の中へ金属製の電極を挿入します。この電極へ静電気くらいの電圧(数kV)を印加すると、液滴は初期帯電の極性に従って動き始めます。
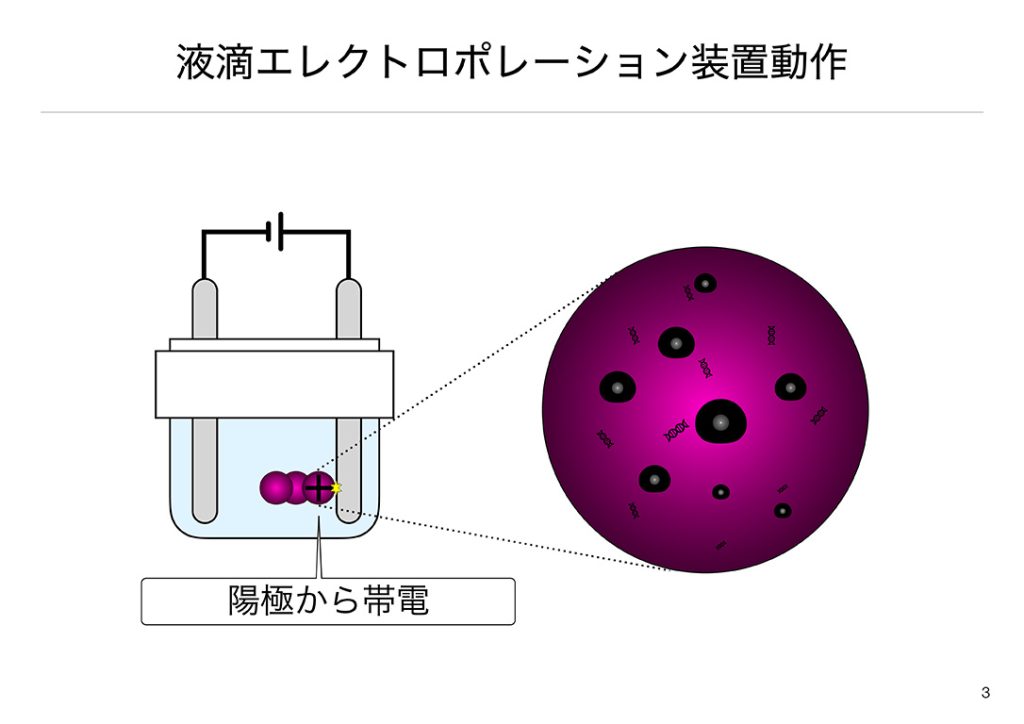
液滴が電極まで到達すると、電極から液滴の充電が行われます。この時、図のように、初期帯電がマイナスなら、液滴表面に蓄えられた電子が電極から吸い取られ、プラスに帯電します。ちょうど、ドアノブに手を触れる瞬間パッチっとくるようなイメージです。プラスの帯電によりマイナス電極からクーロン力による引力が働き、液滴はマイナス電極へ向かいます。
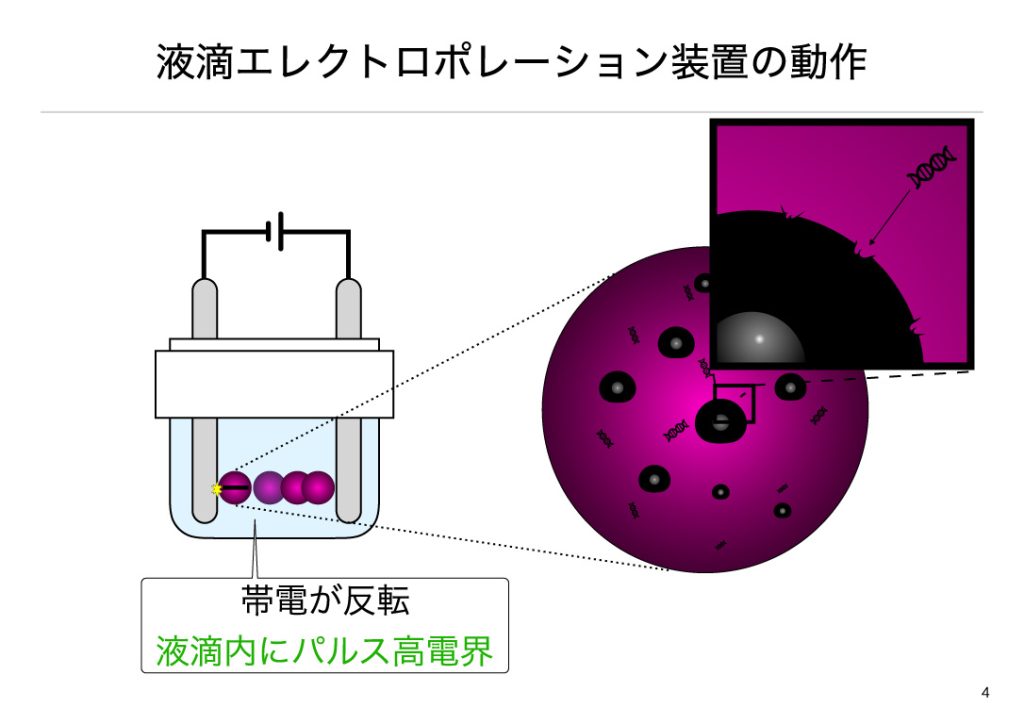
マイナス電極へ液滴が到達すると、電極表面の電子が液滴表面へなだれ込み、プラス極に液滴が接触した時と同様、液滴の帯電が瞬時に変化します。以上のような理論を繰り返し液滴が往復運動します。液滴が往復運動する最中で、金属電極へ接触するたびに液滴の帯電が変化し、液滴両端間に高い電界が発生します。このようにして静電気を遺伝子導入に利用しております。
実際にこの装置を用いて遺伝子導入を行うと、多種の細胞へ遺伝子導入できることから、この短時間の高電界により遺伝子導入が行われていると考えています。液滴エレクトロポレーション法による遺伝子導入は非常に細胞毒性が低いが、細胞毒性に対する遺伝子導入効率が高い特徴があります。
当研究室の見解では、この遺伝子導入効率の高さは、液滴という小さな反応場により遺伝子導入が行えることが、関係しているのではないかと考えております。
現在、液滴エレクトロポレーション法の遺伝子導入効率を向上させることや適応細胞種を広げることを目的にした遺伝子導入精度向上の研究、液滴エレクトロポレーションを再生医療に応用するための研究、液滴エレクトロポレーションからヒントを得た新しい方式の低細胞毒性遺伝子導入装置の開発を行なっています。
細胞への遺伝子導入の革新的新法「液滴エレクトロポレーション」の開発
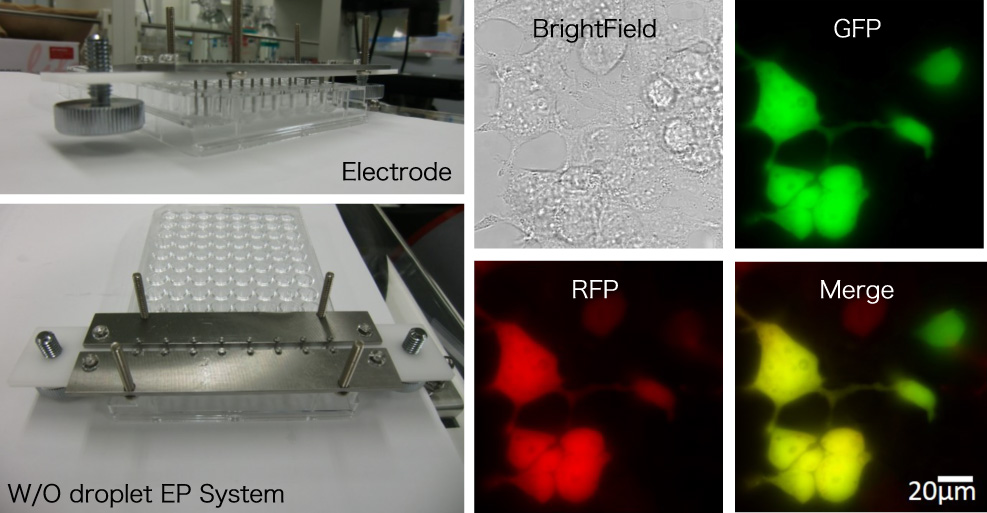
液滴エレクトロポレーションによる哺乳類細胞への形質導入
当研究室では、液滴エレクトロポレーションという、革新的な細胞への遺伝子導入法を開発した。絶縁体の油中の細胞と外来性DNAを封入した数マイクロリットルの液滴に直流電界を印加すると、油中の電極間を液滴が往復運動する。電極の接触時の電荷の反転時や、短絡現象が生じる間に、微量な電流が印加され、DNAが細胞膜内に導入され、細胞の生理機能が変化する。この技術は、使用する細胞やDNA量を大幅に削減可能であり、細胞への毒性が低く、ハイスループットのスクリーニングが可能である、この技術を用いて、iPS細胞の量産化やマルチ遺伝子改変など医学にも革新をもたらすことができる。
主な業績
- Novel Parallelized Electroporation by Electrostatic Manipulation of a Water-in-Oil Droplet as a Microreactor.
Kurita H, Takahashi S, Asada A, Matsuo M, Kishikawa K, Mizuno A, Numano R.PLoS One. 2015 Dec 9;10(12):e0144254.
DOI: 10.1371/journal.pone.0144254 - Fundamental study on agenetransfectionmethodologyfor mammalian cellsusingwater-in-oildropletdeformationinaDC electric field
Kurita H, Takao Y, Kishikawa K, Takashima K, Numano R, Mizuno A.Biochemistry andBiophysicsReports, 2016,8,p81–88
DOI:10.1016/j.bbrep.2016.08.001
キーワード
液滴、エレクトロポレーション、形質導入、iPS細胞の量産化





